Anvisa interrompe estudos clínicos de vacina que estava sendo testada na Capital
Órgão interrompeu os estudos devido a um "evento adverso grave"
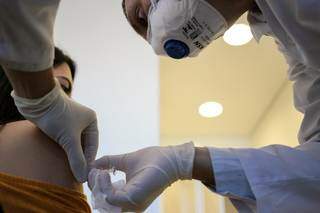
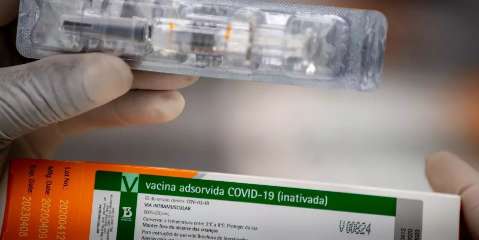
Devido a um "evento adverso grave" a Anvisa (Agência Nacional de Vigilância Sanitária) determinou, na noite desta segunda-feira (09), a interrupção de estudo clínica da vacina Coronavac.
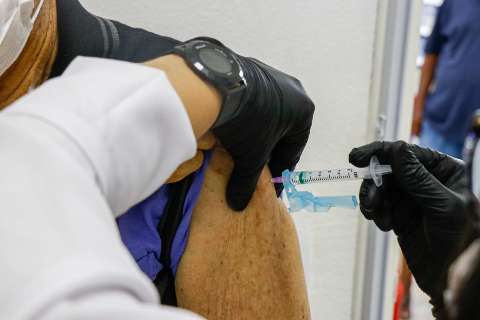
O medicamento era considerado, até então, um dos mais seguros e promissores, possíveis imunizantes da covid-19, e inclusive foi aplicado em voluntários na Capital, durante a fase de testes. Até a última quinta-feira (05) 60 servidores da saúde já haviam tomado a vacina, em Campo Grande.
Entretanto, segundo a Anvisa, por conta do evento ocorrido no dia 29 de outubro o órgão decidiu interromper o estudo para "avaliar os dados observados até o momento e julgar sobre o risco/benefício da continuidade do estudo". Com a interrupção do estudo, nenhum novo voluntário poderá ser vacinado.
A anvisa não divulgou qual seria esse "evento", mas segundo o órgão são considerados eventos adversos graves: óbito; evento adverso potencialmente fatal (aquele que, na opinião do notificante, coloca o indivíduo sob risco imediato de morte devido ao evento adverso ocorrido); incapacidade/invalidez persistente ou significativa; exige internação hospitalar do paciente ou prolonga internação; anomalia congênita ou defeito de nascimento; qualquer suspeita de transmissão de agente infeccioso por meio de um dispositivo médico e evento clinicamente significante.
A Coronavac, desenvolvida pela marca chinesa Sinovac com o Instituto Butantan, estava repetindo os resultados de segurança que já haviam sido registrados em testes de fases 1 e 2 na China. Além da Coronavac, outras três vacinas contra a covid-19 estão em processo de estudos no Estado. A Janssen-Cilag, da multinacional Jhohson e Jhonson; a desenvolvida pelo laboratório Sanofi e a do medicamento contra a BCG.